Hoy os traemos una de las leyes de física de los gases más importantes, la Ley de Boyle-Mariotte. A continuación os dejamos una ficha con un dibujo explicativo para que podáis comprender la dinámica de funcionamiento de esta ley.
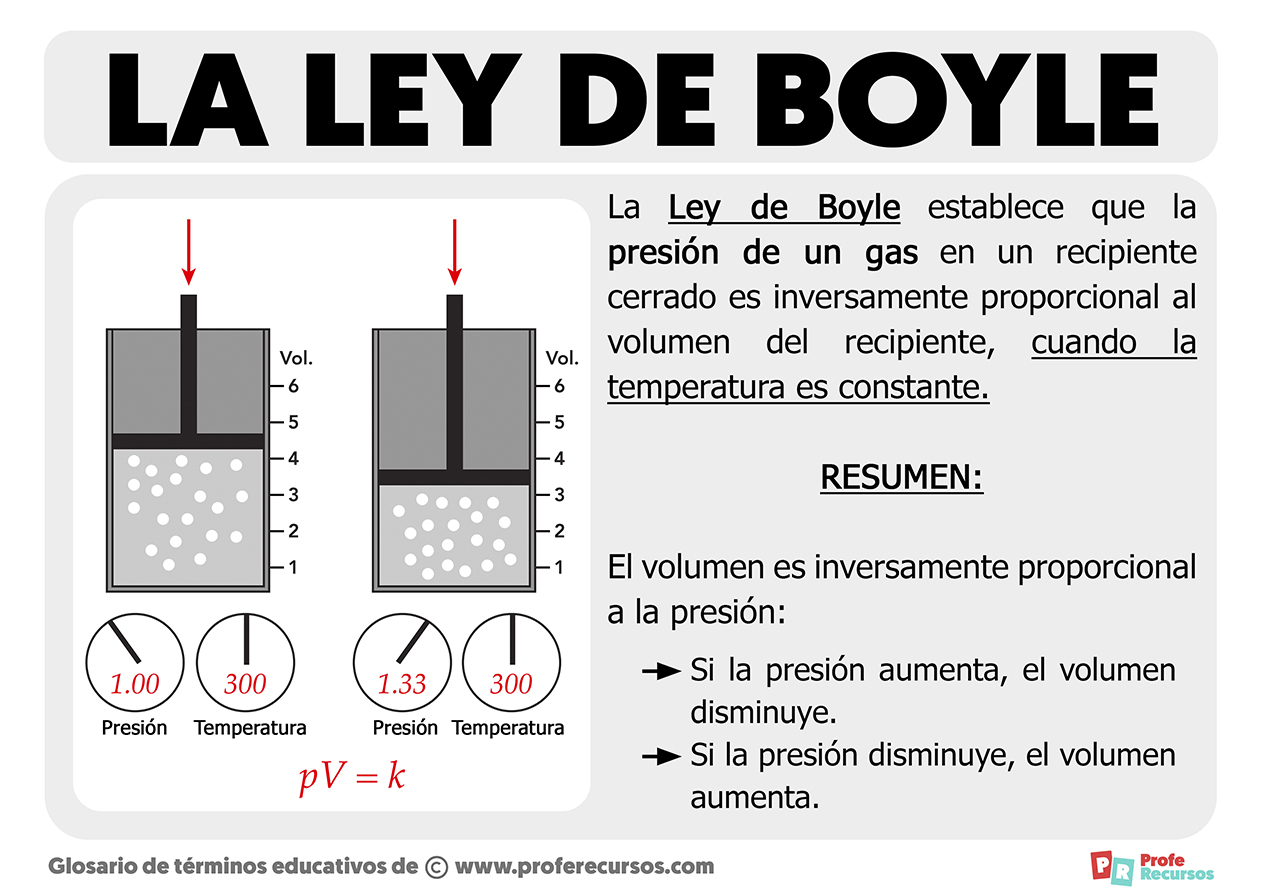
La Ley de Boyle nos viene a decir que que la presión de un gas que se encuentra en el interior de un recipiente cerrado es inversamente proporcional al volumen del propio recipiente, siempre y cuando la temperatura sea constante. Es decir, la ley de Boyle-Mariotte nos dice que el volumen es inversamente proporcional a la presión.
Ejemplo para entender la Ley de Boyle
Esto lo podemos observar claramente en la ilustración que acompaña a la ficha, donde vemos que en el recipiente de la izquierda, el volumen que ocupa el gas es mayor, siendo la presión de 1.0. Mientras tanto, al ejercer presión y aumentar esta (recipiente de la derecha) el volumen disminuye haciéndose el recipiente que ocupa el gas mucho más pequeño.
Conclusión de la Ley de Boyle
Por lo tanto, podemos llegar a la conclusión de que a una temperatura constante, si la presión aumenta, el volumen disminuye y si la presión disminuye, el volumen aumenta.



Deja tu comentario