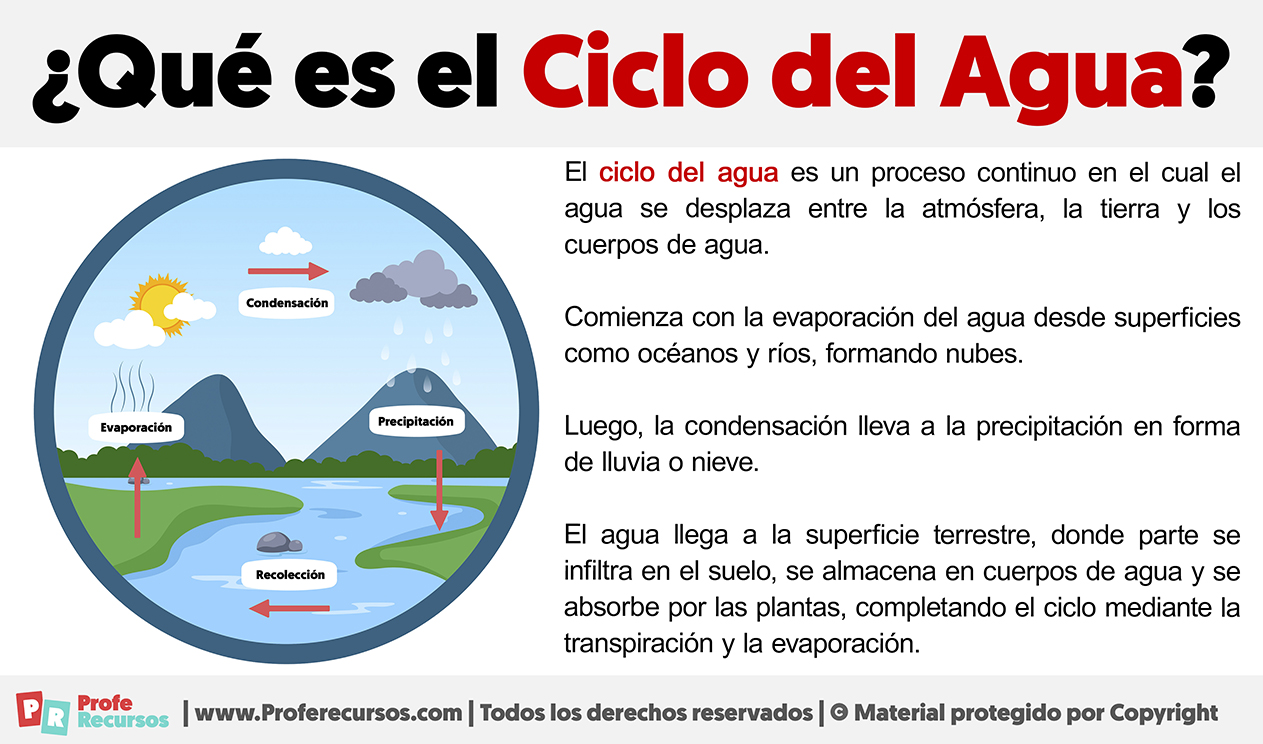
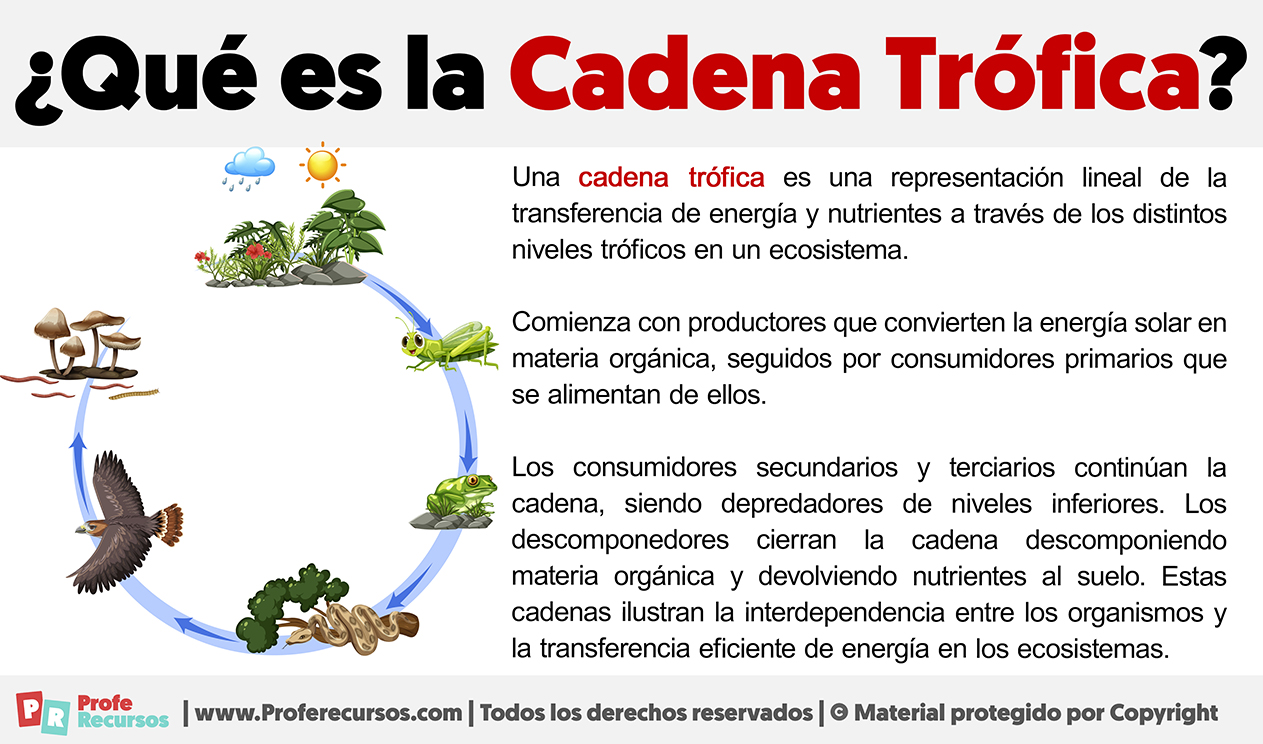
¿Qué es el Ciclo del Agua?
El ciclo del agua es un proceso continuo en el cual el agua se desplaza entre la atmósfera, la tierra y los cuerpos de agua. Comienza con la evaporación del agua desde superficies como océanos y ríos, formando nubes. Luego, la condensación lleva a la precipitación en forma de lluvia o nieve. Descargar ficha El agua llega a la superficie terrestre, donde parte se infiltra en el suelo, se almacena en cuerpos de agua y se absorbe por las plantas, completando el ciclo mediante la transpiración y la evaporación.